2019-08-16
前言
抗原 (靶点)的选择一直是CAR-T领域的研究重点,在上一期已详细介绍。但是仅仅有合适的抗原,缺乏共刺激信号,T细胞往往会未老先衰,起不到抗肿瘤的作用。最新的各种证据已表明,除了CAR结构中的胞外域,其共刺激域也能够对CAR-T细胞的活性,以及最终的疗效和毒性产生很大影响。也就说在CAR-T的结构中,任何一个部件都起着关键作用,所以本期我们就来看看CAR-T结构组成及其功能。
嵌合抗原受体(CAR,Chimeric antigen receptor)-T细胞免疫疗法是一种过继性细胞免疫疗法,它是利用基因技术,在T细胞内导入一个可以将CAR表达于其表面的融合基因,并使T细胞发挥作用,克服肿瘤局部免疫抑制微环境,打破宿主免疫耐受状态,靶向杀伤肿瘤细胞。
https://v.qq.com/x/page/m09146z85ox.html
CAR-T杀伤肿瘤的流程视频(来自Kite官网)
CAR主要由三个功能域构成,分别是胞外结构域、跨膜结构域和胞内结构域。胞外结构域由负责识别并结合抗原的单克隆抗体的单链可变片段(single-chain variable fragment,scFv)及一段起连接作用的铰链区(Hinge)构成。胞内结构域由共刺激结构域(Costimulatory Domain)和信号转导结构域(Signaling Domain)构成[1]。

图1. CAR的结构组成及作用机理
01、胞外结构域
1. 抗原识别结构域(scFv)
▲ 结构组成:抗原识别结构域是CAR特异性结合肿瘤抗原的基础,其主要结构是scFv,由单克隆抗体的轻链(VL)和重链(VH)通过多肽连接而成,保留有抗体对抗原的特异性和亲和力[2]。
▲ 功能:scFv赋予了T细胞特异性识别并结合靶抗原的能力,与未经修饰的天然TCR-T细胞相比,其对靶抗原的亲和力显著提高。CAR-T细胞通过scFv对靶抗原的识别结合不依赖MHC抗原呈递,一方面避免了肿瘤细胞通过调节MHC分子发生逃逸,另一方面赋予了CAR-T细胞识别非肽抗原的能力[3]。
▲ 研究进展:目前大部分CAR-T研究是靶向TAA的,如包括CD19、CD20、CD22、CD30、CD33、BCMA等,也就是说临床上主要是针对这些靶点来开发抗体。不过目前CAR-T临床研究所用的scFv多源于小鼠,这无形中增加了宿主对CAR-T细胞的免疫排斥反应,发生细胞毒性或降低了CAR-T的持续性[4]。因此,开发人源化或全人源的抗体来源的scFv,降低CAR-T细胞的免疫原性,是CAR-T研究面临的关键问题之一。
2. 铰链区(Hinge)
▲ 结构组成:铰链区连接scFv和跨膜结构域,大多数CAR的铰链区由IgG的铰链或CD8α/CD28胞外区衍变而来。铰链区的长度取决于靶细胞抗原表位的位置及暴露程度。
▲ 功能:多项研究表明,CAR-T细胞活化与铰链区长度有关。调整铰链区的长度可以使CAR-T细胞和靶细胞处于最佳距离,在抗原抗体结合过程中避免大型磷酸酶的作用减弱CAR信号。然而,在某些情况下,抗原表位可能相对不可接近,需要使用更长的铰链区,使scFv可以克服空间位阻,有效结合抗原[5]。因此,抗原表位不同,铰链区的最佳长度也不同,在靶向新抗原时,可能需要相应地调整铰链区的长度。
02、跨膜结构域
▲ 结构组成:跨膜结构域将CAR的细胞外结构域与细胞内信号转导结构域连接,并将受体锚定到T细胞膜上。常用的跨膜结构域来源于CD4,CD8α,CD28和CD3ζ[6]。
▲ 功能:如CD3ζ跨膜域能够使CAR形成同源二聚体或与内源TCR形成异二聚体,增强CAR-T细胞活性,但也正是由于其不需要与内源TCR结合即可高度活化T细胞,而逐渐被弃用。CD8α和CD28的跨膜域由于能够促进CAR在细胞表面表达,目前在多数临床试验中采用[7]。
03、胞内结构域
1. 共刺激域(Costimulatory Domain)
▲ 结构组成:共刺激域通常来自CD28受体家族(CD28,ICOS)或肿瘤坏死因子受体家族(4-1BB、OX40、CD27)。
▲ 功能:共刺激域可实现协同刺激分子和细胞内信号的双重活化,使T细胞持续增殖并释放细胞因子,提高T细胞的抗肿瘤能力。如CD28共刺激域使CAR-T细胞依靠糖酵解代谢,促使CAR-T细胞向效应T细胞分化。而4-1BB共刺激域促进线粒体生成,增强呼吸作用和脂肪酸氧化,抗原刺激后,CAR-T细胞优先分化为中央记忆T细胞[1]。
▲ 研究进展:不过究竟是哪个共刺激结构域更好?科学家们仍在一直探索,如2018年,《Science Signaling》期刊上一篇文章比较了这两种结构,结果发现:CD28表现出更快、更强的信号活动,而4-1BB则相对更慢、更温和。但是,4-1BB有着“延长T细胞寿命并维持其抗癌作用”的潜在优势[8]。
2. 信号转导结构域(Signaling Domain)
▲ 结构组成:信号转导结构域通常为T细胞受体TCR/CD3ζ链或免疫球蛋白Fc受体FcεRIγ链,含有免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs,ITAMs)[1]。
▲ 功能:发挥T细胞信号转导功能。
04、CART的发展历程与未来趋势
了解了上述各个部件后,是否对于CAR的功能更加了解呢?简单来说,当T细胞表达某种嵌合抗原受体时,它们能被特定的抗原激活,启动ζ信号,ζ信号和其他信号(CD28或者OX40的可以启动增殖或者存活信号)共同作用可以引起T细胞的激活,靶向杀伤肿瘤细胞。
目前根据CAR结构是否含有共刺激结构域,可分为3代CART,即无共激区/单共激区(CD28或4-1BB)/双共激区(CD28+4-1BB)[9]。
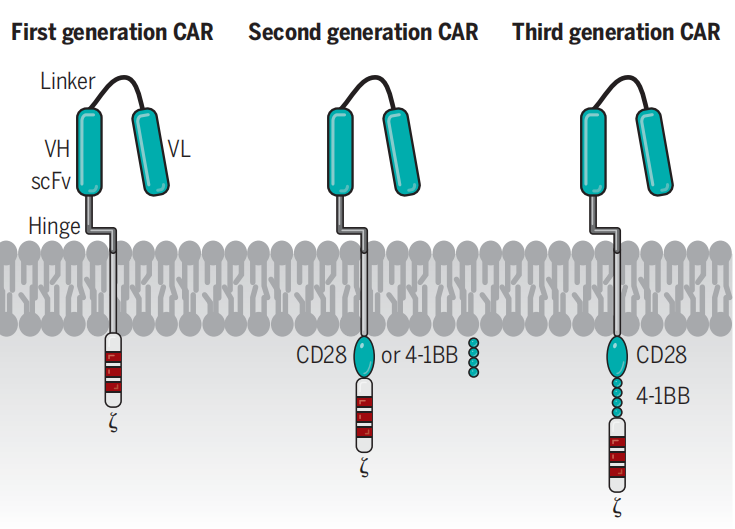
图2. 三代CAR结构比较[9]
▲ 第一代CAR-T细胞:胞内域CAR结构中只有信号转导结构域,CAR-T细胞活性差,体内存活时间短;
▲ 第二代CAR-T细胞:引入了共刺激域 (如:单共激区CD28或4-1BB),可使CAR-T细胞持续增殖并释放细胞因子,增强抗肿瘤活性;
如已上市的两款药物均为二代CART,如诺华的Kymriah的共刺激结构域是4-1BB,而吉利德的Yescarta的共刺激区是CD28。
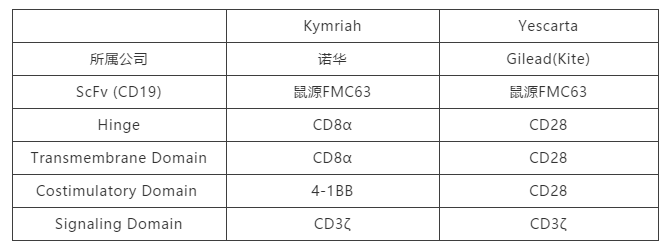
表1. Kymriah和Yescarta结构比较
▲ 第三代CAR-T细胞:包含两个共刺激域(如:CD28+4-1BB),可使T细胞持续活化增殖,增强杀伤肿瘤细胞作用;
一些临床前研究表明,与第二代CAR-T细胞相比,第三代CAR-T细胞表现更好;然而,有些研究则没有发现差异;甚至在某些情况下,第三代CAR-T细胞的表现比第二代更差。这说明体外测量的CAR-T细胞效价并不能总是准确预测其在体内的功能[10-12]。
虽然,目前二代CAR-T技术的研发仍处于主流地位,但各大公司仍在积极探寻新的方向,例如同种异体CAR-T(UCAR-T)设计,可调控CAR活性的设计等等。随着临床研究的深入,研究者们除了研发新的识别肿瘤靶点,也在安全性、CAR-T体内持续性、识别多靶点等多个方向解决肿瘤复发、可能发生的副反应、实体瘤疗效差等诸多问题。未来,随着成本的下降和医保的逐渐纳入,相信CAR-T细胞治疗可以成为普通百姓可以用得起的治疗方式。谈癌色变的时代终将过去,人类生命健康事业已经起航!
参考文献:
1. Stoiber, S. et al. Limitations in the Design of Chimeric Antigen Receptors for Cancer Therapy. Cells 2019, 8, pii: E472.
2. Bird, R.E. et al. Single-chain antigen-binding proteins. Science 1988, 242, 423-426.
3. Posey, A.D. et al. Engineered CAR T cells targeting the cancer-associated Tn-glycoform of the membrane mucin MUC1 control adenocarcinoma. Immunity 2016, 44, 1444-1454.
4. Maus, M.V. et al. T cells expressing chimeric antigen receptors can cause anaphylaxis in humans. Cancer Immunol. Res. 2013, 1, 26-31.
5. James, S.E. et al. Antigen sensitivity of CD22-specific chimeric TCR is modulated by target epitope distance from the cell membrane. J. Immunol. 2008, 180, 7028-7038.
6. Zhang, T. et al. An NKp30-based chimeric antigen receptor promotes T cell effector functions and antitumor efficacy in vivo. J. Immunol. 2012, 189, 2290-2299.
7. Kochenderfer, J.N. et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood 2010, 116, 4099-4102.
8. Ramello, M.C. et al. An immunoproteomic approach to characterize the CAR interactome and signalosome. Science Signaling 2019, 12, pii: eaap9777.
9. June, C.H. et al. CAR T cell immunotherapy for human cancer. Science 2018, 359, 1361-1365.
10. Zhong, X.S. et al. Chimeric antigen receptors combining 4-1BB and CD28 signaling domains augment PI3kinase/AKT/Bcl-XL activation and CD8+ T cell-mediated tumor eradication. Mol. Ther. 2010, 18, 413-420.
11. Yi, Z. et al. Optimizing EphA2-CAR T cells for the adoptive immunotherapy of glioma. Mol. Ther. Methods Clin. Dev. 2018, 9, 70-80.
12. Abate-Daga, D. et al. A novel chimeric antigen receptor against prostate stem cell antigen mediates tumor destruction in a humanized mouse model of pancreatic cancer. Hum. Gene Ther. 2014, 25, 1003-1012.