2019-10-17
RNA作为以DNA单链为模板的遗传信息载体,其编辑相比DNA编辑而言,由于不会永久改变基因组,因此在安全性上有着不言而喻的优势。然而相对于DNA编辑,靶向RNA的编辑还没完全被大众熟悉,其实从上个世纪90年代起,对RNA编辑的自然过程已有了较多的认识。近年来也逐渐开始进化成为真正的RNA“编辑器”,并且已进入一个快速前进的轨道,上一期已为大家介绍了自然状态下RNA在翻译前的调节过程及操作原理,本期具体看看这些神奇的RNA编辑工具。
DNA和RNA的编辑最新发展是基于对ADAR蛋白以及CRISPR技术相关的酶的研究。对这些酶的深入认识为有效地操纵特定的分子特征以测试其功能开辟了新的机会。从整体上来划分,我们可以把RNA编辑(操作)工具分为两大类,其实也就是两大类酶复合物。这两类工具在不同的角度对RNA进行“编辑”,大大拓宽了我们对RNA进行操作的能力。
1.一种是RNA效应元件,这些效应元件主要是可以对RNA进行识别,靶向与切割,这种“编辑”是一种较为宽泛意义上的编辑;
2.另一种可称为单碱基RNA编辑器,这类编辑器主要依托于ADAR蛋白或ADAR蛋白的变体,可以在单个碱基尺度上完成RNA水平上的“A-to-I”或“C-to-U”,并且具有较强的单碱基突变型遗传疾病的治疗潜力。
RNA效应元件的开发
如小编之前所说,RNA效应元件可以对RNA进行识别,靶向与切割。看到这几个词,大家或许很快就想到了我们以CRISPR/Cas为代表的基因编辑工具。确实,在CRISPR/Cas诞生之后,科学家们也在一直思考,是否可以将基于Cas蛋白结合DNA的一些特性与应用转移至RNA上。而正是在这样的想法催生下,基于CRISPR的RNA效应物诞生了。接下来就一起看看其中的代表吧。
1. RCas9
命名:RCas9,顾名思义,就是RNA靶向的Cas9(RNA-targeting Cas9)
研究团队:基因编辑技术研究的领军人物Jennifer Doudna的团队于2014年开发得到 [1]
原理:利用Cas9可识别与结合PAM序列的原理,设计了一种被称为PAMmers的PAM递呈寡核苷酸,可以让Cas9特异定向识别并结合到单链RNA(ssRNA)特异位点上并完成切割。如果将RCas9与一种蛋白质翻译起始因子连接到一起并靶向特异的mRNA,那么就还可以起到对这个蛋白翻译水平的调节。
应用:两年后,Yeo实验室与Jennifer合作,采用RCas9对ACTB、TFRC和CCNA2等内源性转录本进行了编辑,并对融合了荧光蛋白(如GFP)的Cas9进行观察,开发出了在活细胞内追踪RNA运输的工具,在胞内RNA研究上更进了一步[2]。
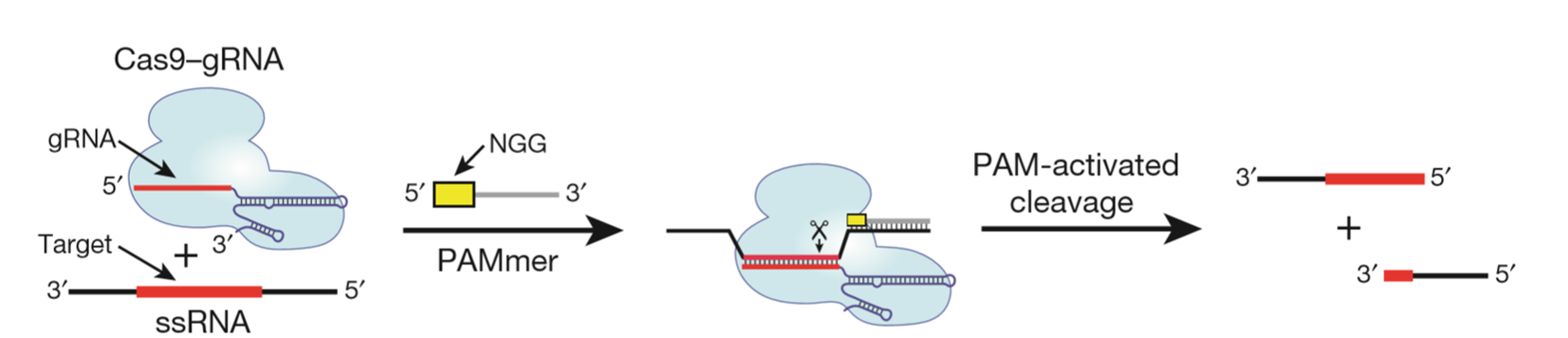
图1. RCas9原理示意图
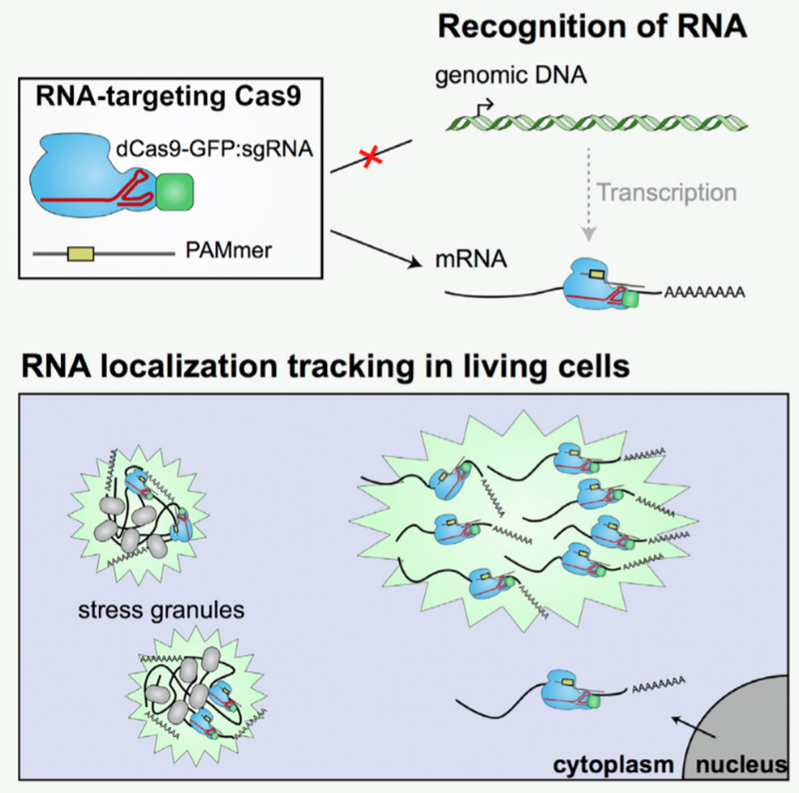
图2. RCas9对活细胞中的RNA进行示踪
2. C2c2
命名:CRISPR/C2c2,亦称Cas13a,是目前第二大类CRISPR/Cas系统中,唯一能够切割RNA的蛋白(诸如Cas9,Cpf1,C2c1等均是RNA介导的DNA内切酶);
研究团队:基因编辑领域的另一领军人物张峰的团队开发出的RNA靶向元件[3];
原理:C2c2会与成熟的crRNA形成复合物,在不借助tracrRNA的情况下与单链RNA结合,而crRNA则会与类似PAM序列的PFS片段结合,并对单链RNA进行切割,从而降低相应蛋白的表达;
应用:作为一种siRNA的替代手段,做到可调节的基因“敲低”(knock down)。
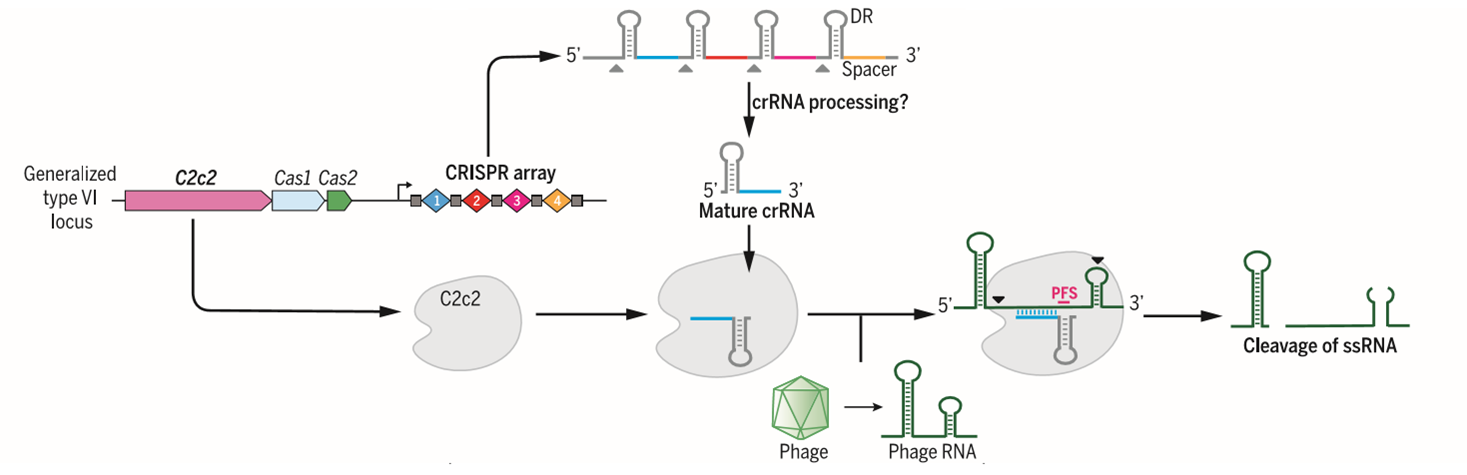
图3. C2c2系统示意图
3. CIRTS
命名:CIRTS(CRISPR-Cas inspired RNA targeting system),一种基于CRISPR/Cas的RNA靶向系统;
研究团队:今年6月,由来自美国芝加哥大学的Bryan C. Dickinson研究团队提出[4];
原理:CIRTS由4个核心组分构成:1)一个RNA发夹结合蛋白(RNA hairpin binding protein),可以在gRNA的引导下与特异性的RNA结构结合;2)一个gRNA,它的结构可以与设计好的发夹结合蛋白相互作用,同时它的序列与靶RNA互补;3)一个单链结合蛋白(ssRNA binding protein),可以与gRNA序列非特异性的结合,对gRNA起到稳定和保护作用;4)一个效应蛋白(effector protein),比如核糖核酸酶或者表观转录调节子,可以对目标RNA起特定作用。
应用:CIRTS的复合物(如:ORF5-TBP6.7-Pin nuclease)对RNA的切割能力与Cas13几乎没有差别,而且可以模块化。由于它的尺寸小(2.7kb),因而可以用AAV有效装载。组分完全来源于人类蛋白,因而可以避免机体产生免疫反应,为基因治疗提供了新的工具。
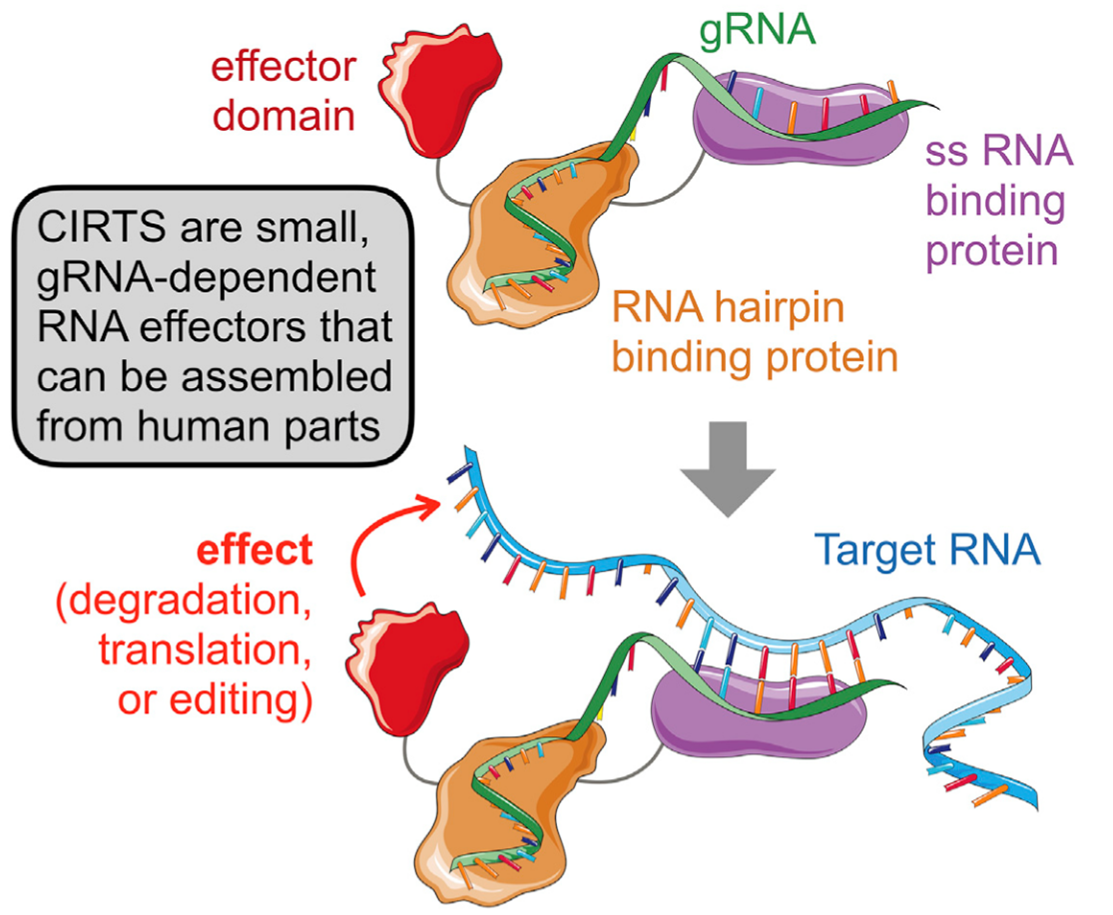
图4. CIRTS原理示意图
单碱基RNA编辑器
顾名思义,单碱基RNA编辑器便是在RNA水平进行单碱基突变矫正的工具,在DNA尺度上,ABE工具可以完美起到“A-to-G”的变化,但是在DNA尺度上,也有这样神奇的RNA“ABE”。与我们熟知的ABE与CBE相比,它又有哪些不同呢?
1. ADAR融合蛋白进行A-to-I编辑
ADAR蛋白(adenosine deaminase acting on RNA)的作用下发生的A-to-I。双链RNA本就可以作为ADAR编辑的底物,而且在许多RNA靶向效应物出现后,科学家们便也开始尝试,是否可以将ADAR或ADAR核心脱氨结构域与这些RNA靶向效应物结合,从而实现在RNA上完成A-to-I(形式上等同于A-to-G)的编辑呢?
研究进展:德国图宾根大学的Thorsten Stafforst团队和波多黎各大学的Rosenthal团队:将ADAR的核心脱氨酶结构域与SNAP-tag[5]或λN肽[6]结合,利用gRNA将复合物(如SNAP-ADAR)携带至靶向编辑位点(与gRNA形成双链区域)进行编辑,成功实现了靶位点A-to-I的转换。
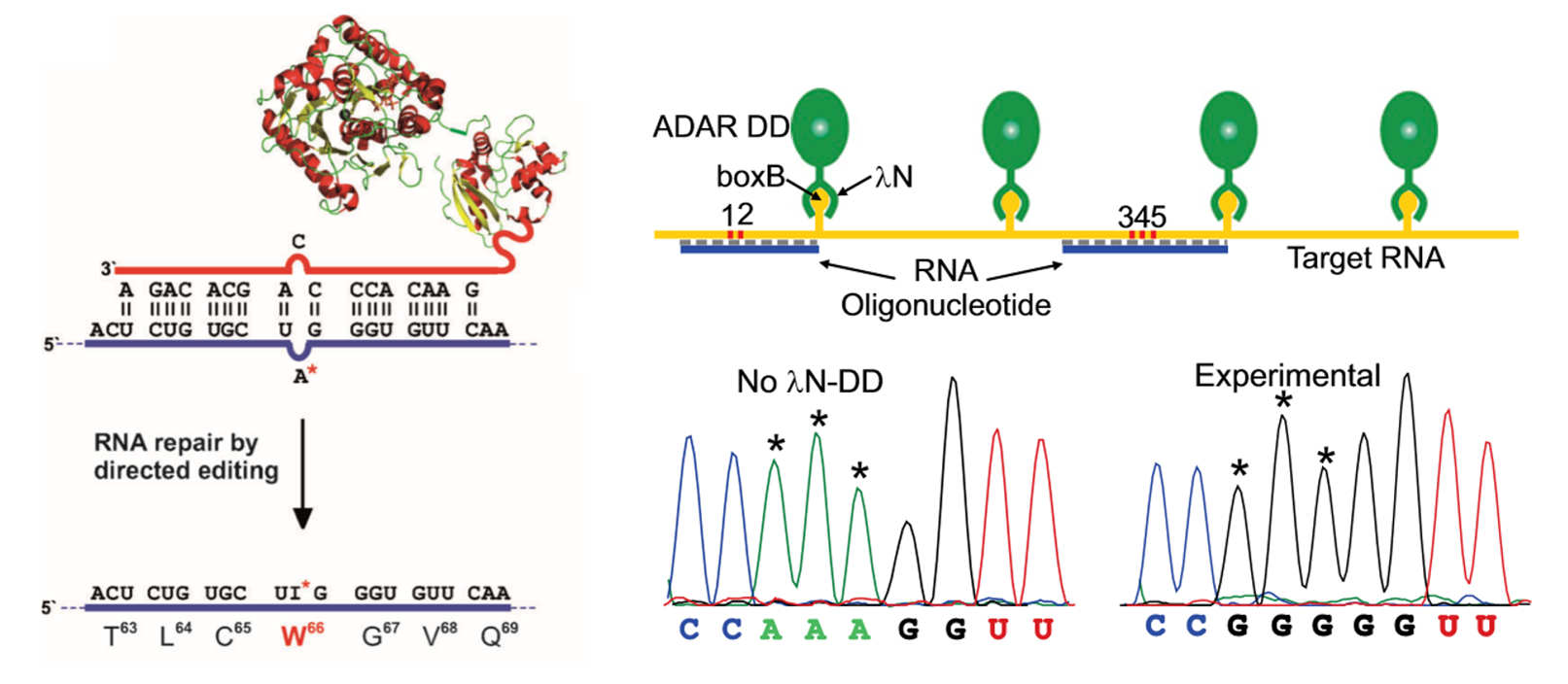
图5. ADAR融合SNAP-tag或λN肽进行A-to-I编辑
张峰团队:在Cas13系统出现后,张峰也将ADAR脱氨酶结构域与dCas13b融合,开发出基于Cas13系统的A-to-I编辑工具:REPEIR(RNA Editing for Programmable A to I Replacement)[7]。
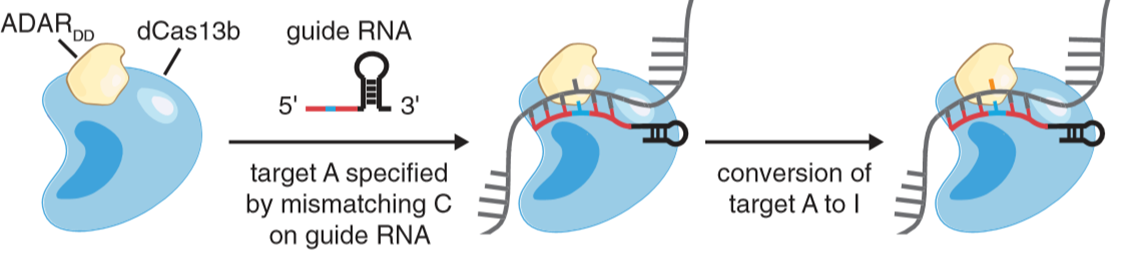
图6. REPEIR原理示意图
2. 利用内源性ADAR进行A-to-I编辑
虽然这样的融合蛋白在RNA的A-to-I编辑上展现出了良好效果,但是仍然存在着几大问题:
蛋白分子量过大,使得通过病毒载体进行装载及人体内递送十分困难;
由于蛋白过表达可能引起潜在的脱靶效应;
外源蛋白表达有可能引起机体产生免疫反应;
机体内的抗体有可能会和蛋白发生中和反应从而导致编辑失败。
在这样的问题之下,科学家们在RNA编辑工具开发上也在尝试进行新的探索。今年的3篇Nature子刊给我们打开了RNA编辑的新思路:那就是利用内源性ADAR来进行RNA编辑。
研究进展:
德国杜宾根大学的Stafforst团队:今年1月在Nature Biotechnology发文,提出了一种名为RSETORE(recruiting endogenous ADAR to specific transcripts for oligonucleotide-mediated RNA editing)的方法。RESTORE使用了一段化学合成的寡核苷酸(ASO)与靶序列进行互补配对,并添加了与靶向GluR2 mRNA相似的R/G motif作为ADAR的招募域(可见上一期公众号对ADAR蛋白原理的介绍),利用人体细胞中已经存在的ADAR蛋白进行RNA编辑[8]。与IFN-α结合,RESTORE的编辑效率甚至可达80%。在研究中,RESTORE高效修复了导致α1-抗胰蛋白酶缺乏的PiZZ突变,并有效编辑了信号因子活性开关STAT1中的重要位点磷酸酪氨酸701。
加州大学圣地亚哥分校的Mali博士:今年2月,在Nature Methods上再度验证,只使用改造过的指导RNA,就可以与ADAR结合并且将它带到正确RNA序列,并且在小鼠模型中修复了与肌营养不良症和鸟氨酸转氨甲酰酶缺乏症相关的突变[9]。
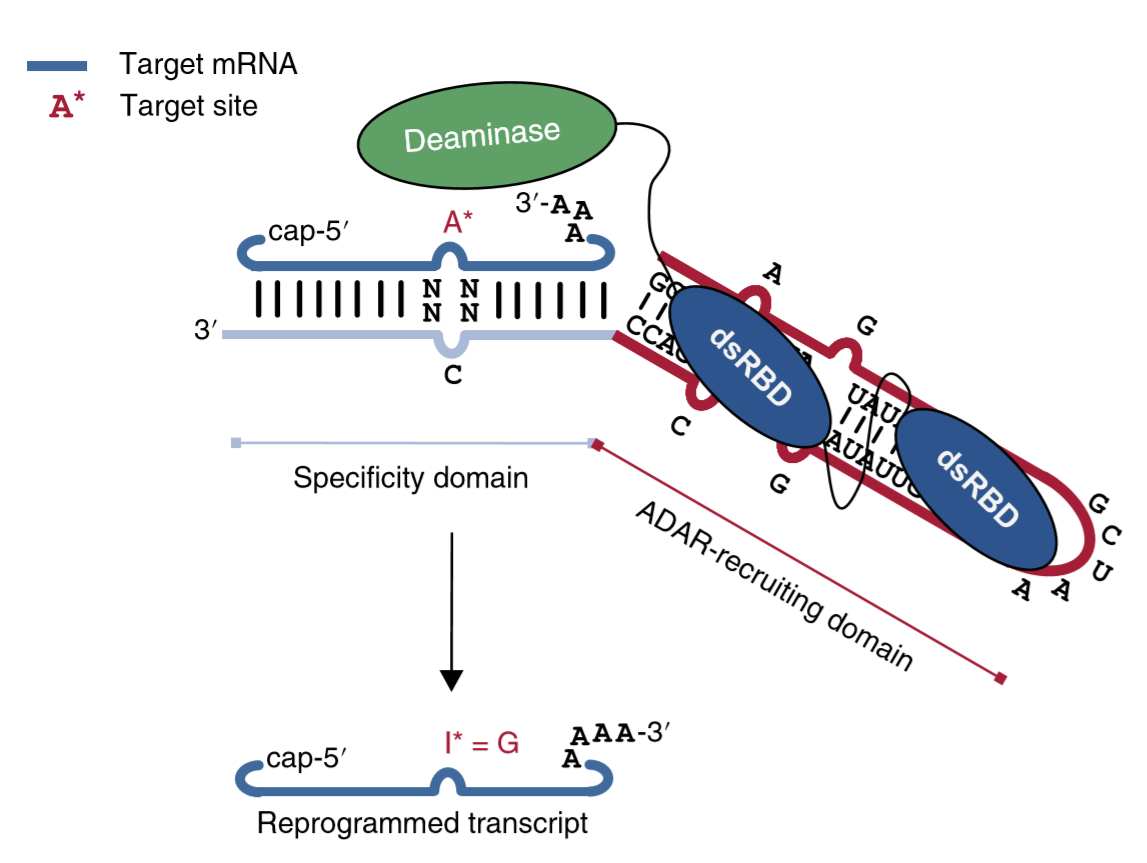
图7. RESTORE原理示意图
北京大学魏文胜课题组:今年7月,也在Nature Biotechnology上发文,提出了一种名为LEAPER(Leveraging Endogenous ADAR for Programmable Editing on RNA)的方法,只需转入一条特殊设计的RNA (arRNA, ADAR-recruiting RNA),就能够通过招募细胞内源的ADAR1 蛋白对靶向基因转录本上特定的A产生高效精准的编辑,并不需要引入任何外源效应蛋白。LEAPER在疾病治疗领域的作用也得到了充分验证。比如LEAPER可以通过修复抑癌基因TP53中的致病突变来恢复p53突变体的转录调节功能。此外,在Hurler综合征患者来源的原代细胞中,LEAPER能够成功修复致病突变,并恢复细胞中的α-L-艾杜糖醛酸酶的催化活性。相比于需要进行化学修饰的RESTORE,LEAPER可以通过稳定表达的方式在细胞内发挥作用,因此适用于装载至腺相关病毒 (AAV)、慢病毒等载体中,在递送至机体后持续发挥功能[10]。
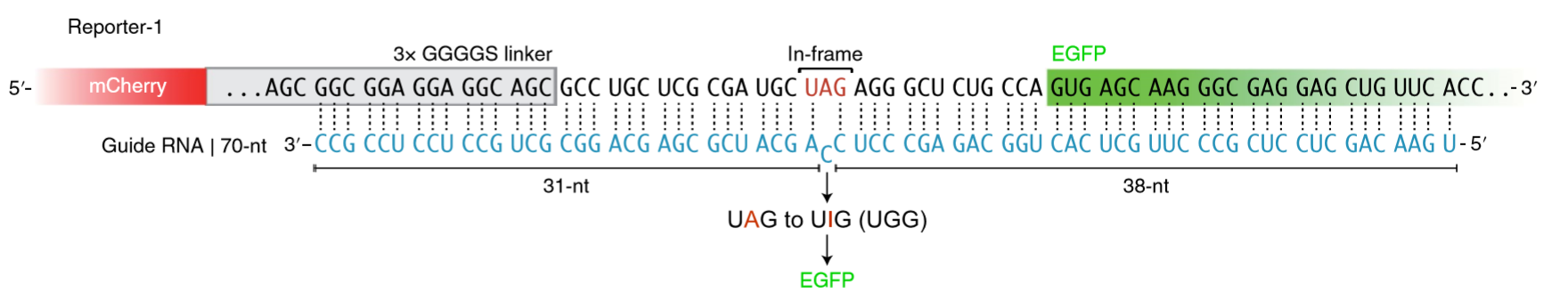
图8. LEAPER原理示意图
3. C-to-U的RNA编辑
虽然ADAR可以良好地完成A-to-I的RNA编辑,但是针对于C-to-U的RNA编辑,先前的科学家们还没有找到较好的手段。
研究进展:今年7月,张峰实验室通过分子进化的方法,使ADAR2酶具有了可以将胞嘧啶(C)转化为尿嘧啶(U)的全新能力,与此同时,它原先将A转化为I的功能依旧得到了保留。通过进一步优化,该工具的脱靶效应也被良好地进行控制。这个全新的C-to-U工具被命名为RESCUE(RNA Editing for Specific C to U Exchange),打开了一个新的RNA编辑世界的大门[11]。为了验证该工具在疾病治疗上的潜力,研究者们对编码与阿尔茨海默病有关的风险因子APOE4的RNA进行了编辑。RESCUE系统成功地将APOE4 RNA中的2个碱基从C变成了U,从而转换为了安全无害的APOE2。
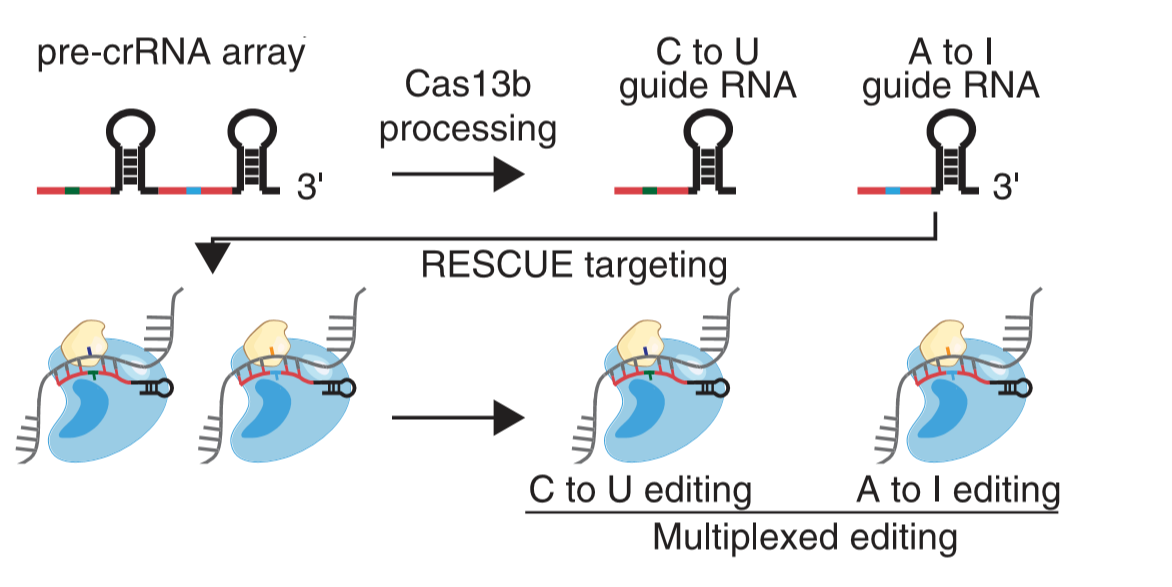
图9. RESCUE原理示意图
看到这里,大家是否对RNA编辑产生一个新的认识呢?这样的工具不仅为RNA的研究开拓的新方向,而且为疾病的基因治疗提供新的工具。当然,除了遗传性疾病之外,在很多肿瘤的发生发展过程之中,也伴随着RNA编辑的发生。那么下一期的公众号,就让我们一起了解一下RNA编辑与肿瘤吧!
参考文献:
[1]O'Connell MR, Oakes BL, Sternberg SH, et al. Programmable RNA recognition and cleavage by CRISPR/Cas9. Nature, 2014, 516 (7530): 263-266.
[2]Nelles DA, Fang MY, O'Connell MR, et al. Programmable RNA Tracking in Live Cells with CRISPR/Cas9. Cell, 2016, 165 (2): 488-496.
[3]Abudayyeh OO, Gootenberg JS, Konermann S, et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science, 2016, 353 (6299): aaf5573.
[4]Rauch S, He E, Srienc M, et al. Programmable RNA-Guided RNA Effector Proteins Built from Human Parts. Cell, 2019, 178 (1): 122-134.
[5]Stafforst T, Schneider MF. An RNA-deaminase conjugate selectively repairs point mutations. Angew Chem Int Ed Engl, 2012, 51 (44): 11166-11169.
[6]Montiel-Gonzalez MF, Vallecillo-Viejo I, Yudowski GA, et al. Correction of mutations within the cystic fibrosis transmembrane conductance regulator by site-directed RNA editing. Proc Natl Acad Sci U S A, 2013, 110 (45): 18285-18290.
[7]Cox DBT, Gootenberg JS, Abudayyeh OO, et al. RNA editing with CRISPR-Cas13. Science, 2017, 358 (6366): 1019-1027.
[8]Merkle T, Merz S, Reautschnig P, et al. Precise RNA editing by recruiting endogenous ADARs with antisense oligonucleotides. Nat Biotechnol, 2019, 37 (2): 133-138.
[9]Katrekar D, Chen G, Meluzzi D, et al. In vivo RNA editing of point mutations via RNA-guided adenosine deaminases. Nat Methods, 2019, 16 (3): 239-242.
[10]Qu L, Yi Z, Zhu S, et al. Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs. Nat Biotechnol, 2019, 37 (9): 1059-1069.
[11]Abudayyeh OO, Gootenberg JS, Franklin B, et al. A cytosine deaminase for programmable single-base RNA editing. Science, 2019, 365 (6451): 382-386.