2019-12-04
2018年,美国FDA和欧洲EMA批准了来自RNA药物制造两大巨头Ionis Pharmaceuticals公司的反义寡核苷酸疗法药物Tegesedi(Inotersen)和Alnylam Pharmaceuticals公司的siRNA疗法药物Onpattro(Patisiran),用于治疗遗传性转运甲状腺素蛋白淀粉样变性,成为了RNA治疗领域新的里程碑。近年来,RNA疗法已经取得了较为长足的发展,大型制药公司也正在不断加大对于RNA药物研究的投资。不过,传统的RNA治疗主要还是集中于ASO与siRNA两大领域,而近年来呈研究上升趋势的RNA编辑为RNA治疗提供了新的选择。那么本期的推送,小编就带大家来看一看我们之前曾详细分析过的RNA编辑是如何应用到肿瘤与遗传疾病治疗中!
正如小编刚刚总结的,传统的靶向核酸的RNA治疗是基于反义寡核苷酸(antisense oligonucleotides, ASO)和RNA干扰(RNAi)两大原理[1]。它们主要都是通过与RNA分子进行互补而起到影响翻译或降解RNA的效果,进而消除错误蛋白对细胞或机体的影响,一些相关药物也已经获批上市。此外,以CRISPR/Cas9为代表的DNA编辑技术已经发展相当成熟,在诸多遗传病治疗中已经显示出其强大的能力,特别是它和肿瘤免疫治疗相结合,已发展成为新一代基因编辑CAR-T技术。那么,在这样的背景之下,为什么我们还要选择RNA编辑作为治疗方式呢?
一、传统RNA疗法与DNA疗法面临的挑战
1. 传统的RNA疗法的局限
ASO与RNAi等传统的RNA疗法虽然取得了很多进展,但仍然存在以下问题:
较多药物稳定性低,具有一定程度的脱靶性,且靶向药物活性较低[2];
它们的脱靶往往会导致内源正常mRNA在翻译前水平的非正常降解;
因此,传统RNA疗法的发展并非一帆风顺。
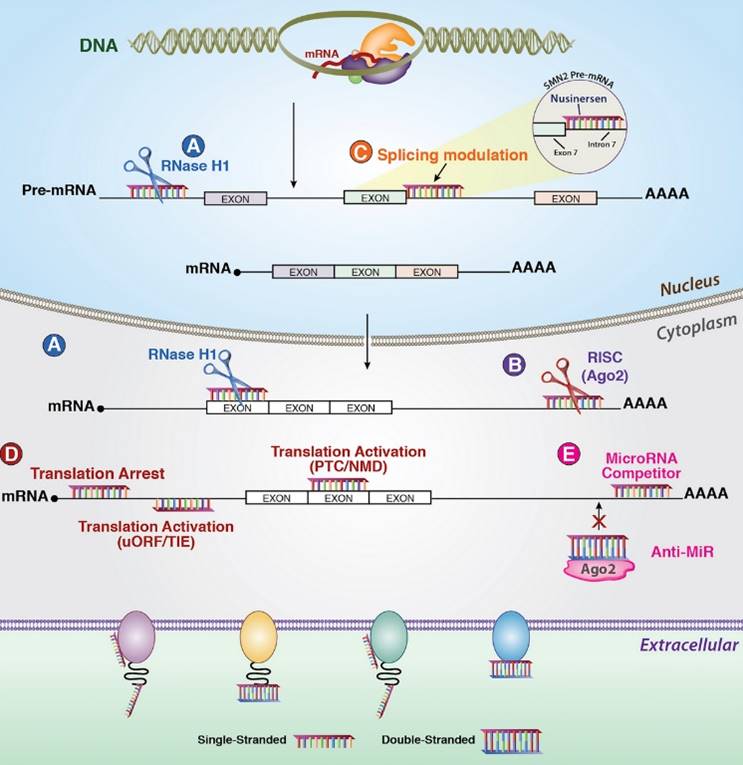
图1. 常见调节基因表达的反义机制[2]
2. DNA疗法的局限
DNA疗法(基因治疗)在现有临床上主要还是采用以病毒为递送载体的过表达系统进行治疗,而基因编辑治疗整体上还是处在基础研究向临床前研究的过度阶段。而此类治疗方式也可能存在着以下问题:
蛋白分子量过大,使得通过病毒载体进行装载及人体内递送十分困难;
由于蛋白过表达可能引起潜在的脱靶效应;
外源蛋白表达有可能引起机体产生免疫反应;
正是因为存在着的种种小问题,疾病治疗领域就更需要进行更多新的方法学尝试,进而打开疾病治疗的新大门。
二、RNA编辑的优势
那么,从整体上看,RNA编辑的优势究竟在哪里呢?让我们还是回归到基本的中心法则吧!
1. DNA编辑的顾虑
RNA的生物合成是依赖于DNA的。DNA作为大多数生物(除少数病毒外)遗传信息的基本载体,在生命活动中扮演着重要的角色,但是这也决定了它必须要尽可能少地出现错误。虽然DNA编辑技术有着很强大的功能,但是对DNA进行编辑仍然在很多应用情景下存在着伦理和安全上的顾虑,这样成为了DNA编辑在发展过程中的不可忽视的一大问题。
2. RNA编辑的独到之处
相比于基因编辑是直接在DNA水平进行操作,RNA编辑则是通过ADAR等脱氨酶在RNA尺度上进行单碱基的校正,使得DNA水平的突变可以通过中介调整而产生正确的蛋白。这样,我们就可以在完全不改变DNA序列的情况下纠正蛋白质水平的错误。此外,特定的RNA在体内存在的时间相对较短,相比通过编辑DNA来永久改变基因组,RNA编辑在安全性上也有着不言而喻的优势。
编辑RNA为我们在翻译前修复缺陷蛋白提供了新的思路和可能,是之前传统的RNA疗法和基因疗法都无法做到的,有助于多种疾病的治疗。
三、RNA编辑治疗的进展
由于RNA编辑还是属于较为新兴的研究领域,所以还没有真正进入临床。但是在基础研究领域,许多新的RNA编辑工具已经开始着眼于寻找疾病治疗的应用,如单碱基遗传疾病及癌症等。1. 单碱基遗传疾病治疗
在迄今为止已知的诸多遗传病中,致病类型最多的还是单碱基突变。研究统计结果表明,在已知的与疾病相关的50000种人类基因变异中,由于单碱基的改变而导致疾病的>30000种(图2)。虽然这些突变可能会被ABE或CBE等基因编辑工具较正,但是基于ADAR等的“RNA单碱基编辑器”同样可以在RNA水平纠正突变。下面是一些近期报道的RNA编辑治疗遗传疾病的成功案例。
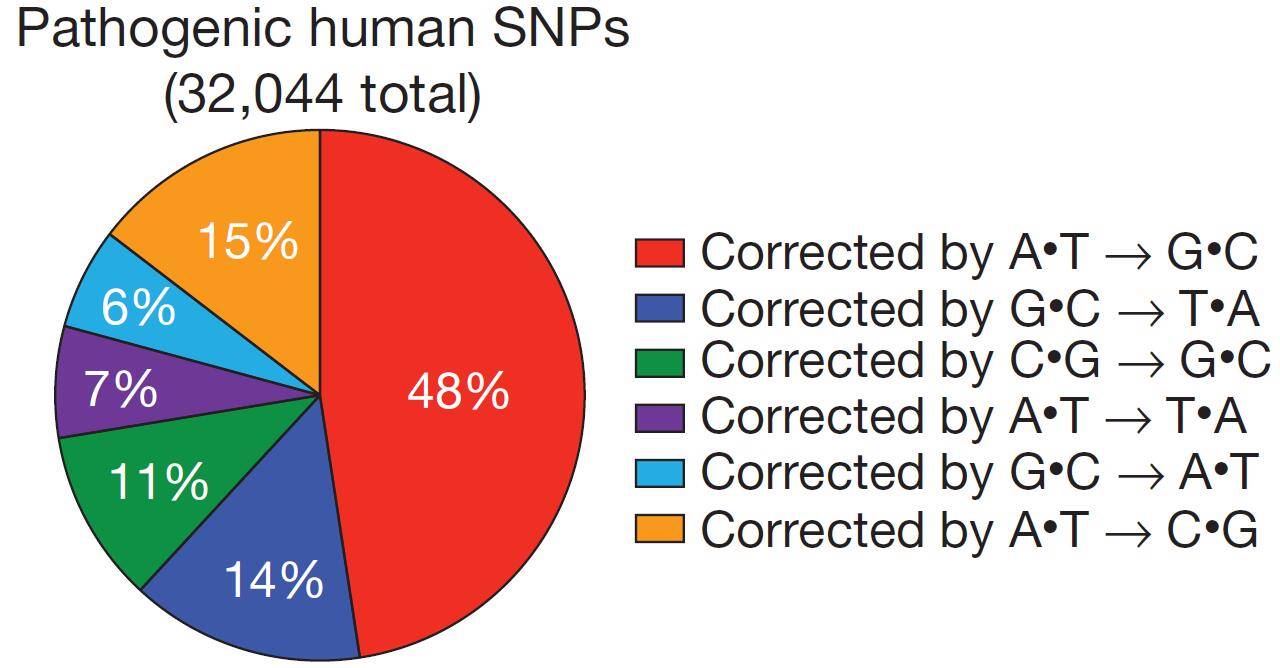
图2. 人类遗传病中单碱基突变类型
A1-AT综合征α1-抗胰蛋白酶缺乏症是血中抗蛋白酶成分:α1-抗胰蛋白酶(简称A1-AT)缺乏引起一种先天性代谢病。SERPINA1 (丝氨酸蛋白酶抑制剂家庭成员1)中的PiZZ突变(E342K)是A1-AT缺陷症最主要的原因。由于PiZZ等位基因的缺失,抗胰蛋白酶功能丧失,对肺和肝脏造成严重损害。
来自德国杜宾根大学的Stafforst团队今年1月在Nature Biotechnology提出的RSETORE工具(可见RNA编辑系列上一篇推文)通过程序化设计的ASO招募内源性ADAR成功修复了E342K的疾病突变,并且在细胞上可以达到接近30%的编辑效率[3]。
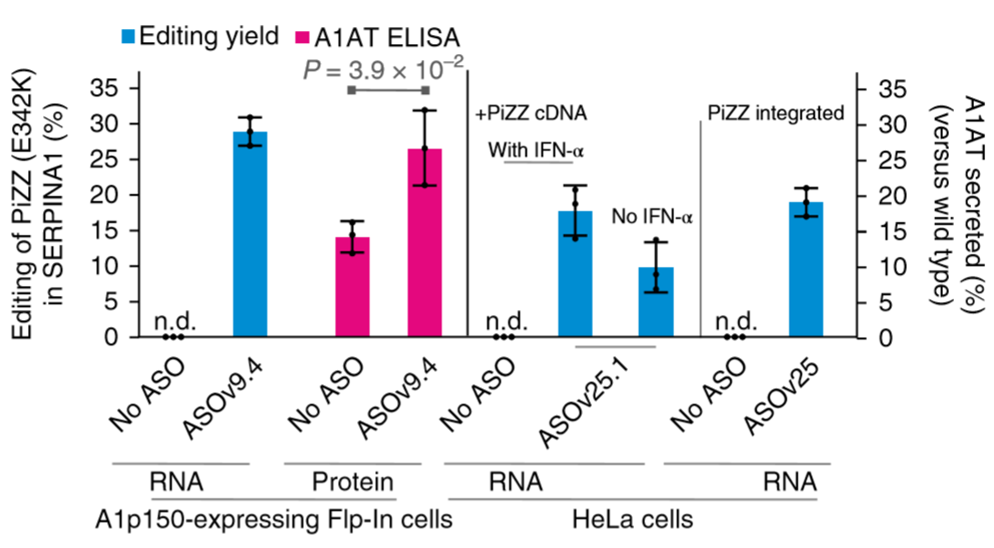
图3. RESTORE修复A1-AT综合征突变
Hurler综合征
又称IH型粘多糖病,是由于α-L-艾杜糖醛酸酶(IDUA)缺乏而导致的一种遗传疾病。北京大学魏文胜课题组于年7月在Nature Biotechnology上提出的一种名为LEAPER的工具(可见RNA编辑系列上一篇推文),通过长链arRNA招募内源性ADAR对Hurler综合征患者原代细胞中的致病突变进行了修复,且基本不出现脱靶现象[4]。
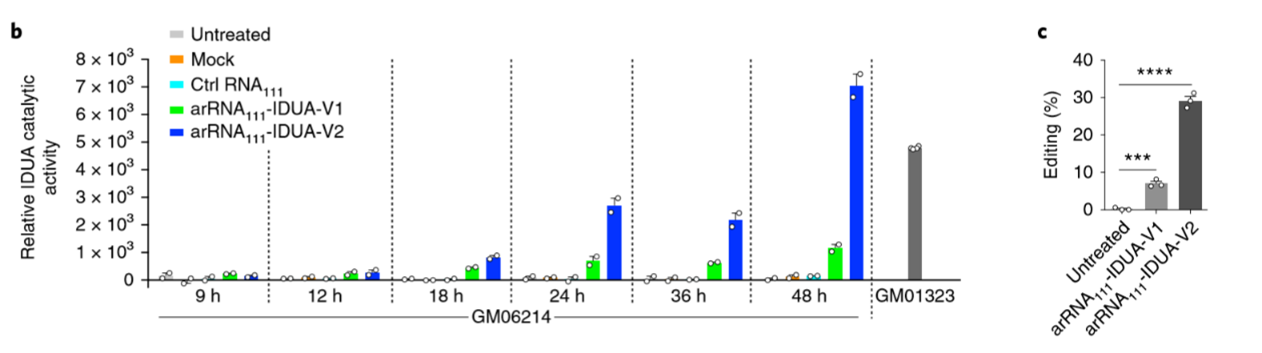
图4. LEAPER对IDUA突变的校正
肌营养不良症和鸟氨酸转氨甲酰酶缺乏症
这两种疾病同样也是来源于活性蛋白(或酶)的缺乏。加州大学圣地亚哥分校的Mali博士使用改造过的指导RNA,将ADAR结合并且将带到正确RNA序列处进行编辑,在小鼠模型中修复了这两类疾病的表型。这也是RNA编辑治疗在动物体内成功的代表性工作[5]。
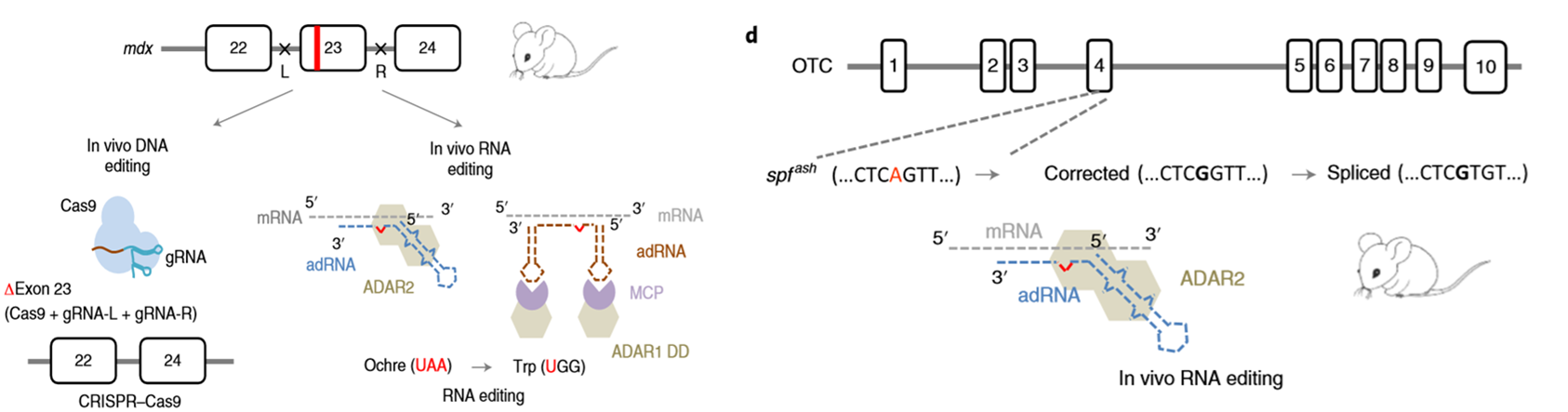
图5. RNA编辑治疗肌营养不良和鸟氨酸转氨甲酰酶缺乏症
2. 癌症的治疗如果说所有癌症都有一个共同点的话,那就是无共同性。为什么每个人的肿瘤都不一样?RNA编辑或许就是幕后黑手之一。腺苷(A)到肌苷(I)的RNA编辑给肿瘤转录组学中引入了许多核苷酸改变,造成肿瘤具有广泛的个体异质性[6];而且异常RNA编辑使致瘤相关基因正常转录RNA翻译出异常蛋白质,导致原蛋白质参与的各种生理功能的异常(如异常编辑PTEN或NF1等重要抑癌基因)。这就使得癌症治疗十分困难!
RNA编辑的出现可以对症下药,将出错的肿瘤转录组或突变原癌/抑癌基因进行纠正,也可以对可能产生癌症的潜在危害进行控制。
下面以抑癌基因P53和β-catenin为例,阐述RNA编辑如何对肿瘤相关基因进行纠正与调控!P53
抑癌基因TP53(P53)在维持细胞稳态中发挥着重要作用,在50%以上的人类癌症中频繁发生突变。TP53中c.158 G-to-A突变是一种临床相关的无义突变(Trp53Ter),会导致非功能性的截短蛋白,进而诱发癌症。同样是刚刚所述的LEAPER工具能有效纠正突变导致的终止密码子,进而产生正常的TP53蛋白[4]。

图6. RNA编辑修复P53突变
β-cateninβ-连环蛋白(β-catenin)是一种与细胞正常生长相关联的蛋白,它的磷酸化会导致蛋白的活化和细胞的生长。如果永久地发生这样的改变,则细胞就会处于一种不受控制的生长状态,可能导致癌症的发生。
张峰团队提出的RESCUE(RNA版本的CBE,见RNA编辑系列上一篇推文)工具通过对RNA的精准编辑,能直接激活β-catenin蛋白,促进细胞生长。如果使用的是传统的DNA编辑手段,β-catenin蛋白就会被永久激活,导致细胞不受控的生长,甚至是产生癌症。但利用RESCUE工具编辑RNA,只会促进短期的细胞生长。既可以促进伤口的愈合,也不会引起不可控的副作用。

图7. RESCUE编辑β-catenin控制细胞生长
怎么样,看过了小编的总结,是不是对RNA编辑在疾病治疗里的应用前景充满了期待呢?虽然现在RNA编辑在治疗中的研究还是属于初级阶段,但是小编相信,随着RNA研究浪潮的来临,RNA编辑治疗会和已经不断前进发展的RNA疗法主流融合并携手,开创分子水平治疗的新时代!
参考文献
[1] Dowdy SF. Overcoming cellular barriers for RNA therapeutics. Nat Biotechnol. 2017, 35 (3):222-229.
[2] Crooke ST, Witztum JL, Bennett CF, et al. RNA-Targeted Therapeutics. Cell Metab. 2018, 27 (4):714-739.
[3] Merkle T, Merz S, Reautschnig P, et al. Precise RNA editing by recruiting endogenous ADARs with antisense oligonucleotides. Nat Biotechnol, 2019, 37 (2): 133-138.
[4] Qu L, Yi Z, Zhu S, et al. Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs. Nat Biotechnol, 2019, 37 (9): 1059-1069.
[5] Katrekar D, Chen G, Meluzzi D, et al. In vivo RNA editing of point mutations via RNA-guided adenosine deaminases. Nat Methods, 2019, 16 (3): 239-242.
[6] Peng X, Xu X, Wang Y, et al. A-to-I RNA Editing Contributes to Proteomic Diversity in Cancer. Cancer Cell. 2018, 33 (5):817-828.
[7] Abudayyeh OO, Gootenberg JS, Franklin B, et al. A cytosine deaminase for programmable single-base RNA editing. Science, 2019, 365 (6451): 382-386.